سوپر اکسید و پراکسید هیدروژن (H2O2) چیست و از کجا میشه خرید؟
سوپر اکسید و پراکسید هیدروژن (H2O2) چیست و از کجا میشه خرید؟
پراکسید چیست؟ هیدروژن پراکسید از کجا بخریم؟ کاربرد آب اکسیژنه (اسید یا باز) در کجاست؟ فرمول شیمیایی یون پراکسید و آب اکسیژنه داروخانه ای + قیمت اسید پراکسید
پراکسید ها :
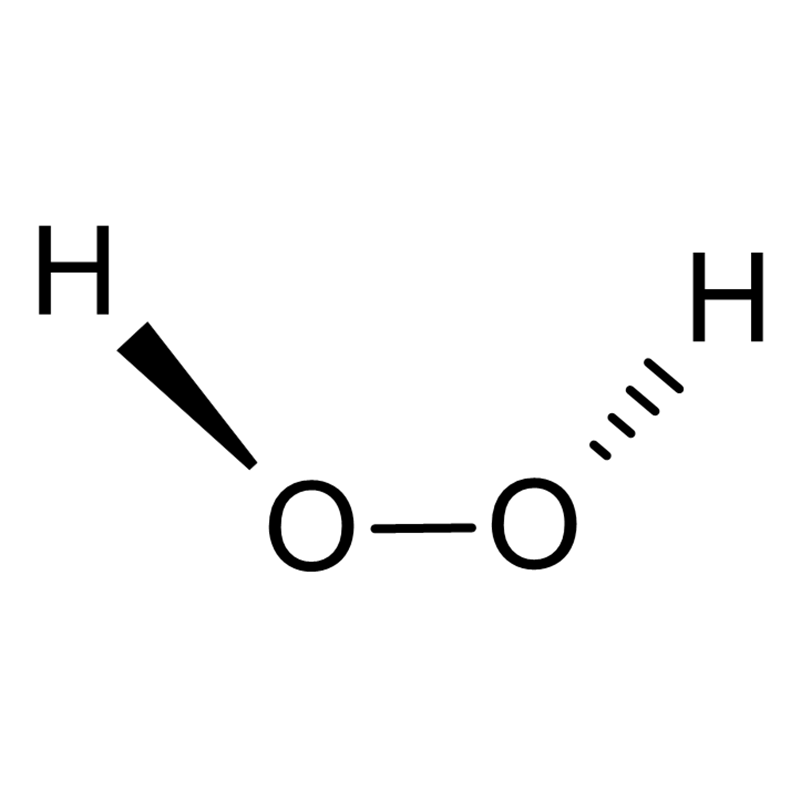
پروکسید ها گروهی از ترکیبات با ساختار R −O −O −R هستند. گروه O-O موجود در پروکسید را “گروه پروکسید” یا “گروه پراکسو” می نامند. در مقابل یون های اکسید، اتم های اکسیژن موجود در یون پروکسید دارای تعداد اکسیداسیون − 1 هستند.
متداول ترین پراکسید، پراکسید هیدروژن (H2O2) است که به زبان عامیانه به سادگی “پراکسید” شناخته می شود. این ماده به عنوان محلول در آب با غلظت های مختلف به بازار عرضه می شود. از آنجا که پراکسید هیدروژن تقریباً بی رنگ است، بنابراین این محلول ها نیز بی رنگ هستند. این ماده به طور عمده به عنوان یک ماده اکسید کننده و سفید کننده استفاده می شود.
انواع :
یون پراکسید، پروکسید آلی، هیدرو پروکسید آلی. پروکسید با رنگ آبی مشخص شده است. R ، R1 و R2 عوارض هیدروکربنی را نشان می دهد.
دو دسته پروکسید وجود دارد که در آن یکی یا هر دو اتم اکسیژن به صورت کوالانسی با اتم های دیگری به غیر از هیدروژن مرتبط هستند. یک دسته توسط کومن هیدروپراکسید، یک ترکیب آلی که به عنوان آغازگر پلیمریزاسیون و به عنوان منبع فنل و استون و اسید پروکسید سولفوریک استفاده می شود، یک ترکیب غیر آلی است که به عنوان یک ماده اکسید کننده استفاده می شود. دسته دیگر شامل دی ترت بوتیل پراکسید و پراکسید سولفات آمونیوم است که هر دو به عنوان آغازگر استفاده می شوند.
سوپر اکسیدها و پراکسیدها چیست :
پراکسیدها در یک پروکسید، حالت اکسیداسیون اکسیژن -1 شناخته می شود در حالی که در یک Superoxide، حالت اکسیداسیون اکسیژن 1/2 شناخته می شود.
جدا از پراکسید هیدروژن، برخی از گروه های اصلی دیگر این ماده عبارتند از :
اسیدهای پراكسی، مشتقات پراكسی بسیاری از اسیدهای آشنا، از جمله اسید پراكسیمونو سولفوریك و اسید پراستیك و نمك های آن ها كه یك نمونه از آن ها پراكسی دی سولفات پتاسیم است.
پروکسید گروه اصلی، ترکیباتی با پیوند E − O − O – E) = Eعنصر گروه اصلی).
پروکسید فلز، به عنوان مثال: باریم (BaO2)، سدیم (Na2O2) و روی (ZnO2).
پروکسید آلی، ترکیباتی با پیوند C − O − O − C یا C − O − O − H. یک نمونه آن ترت بوتیل هیدروپراکسید است.
پروکسید باریم BaO2 یک پروکسید واقعی است. این شامل یون پروکسید، یون O22− است. این یک جامد یونی سفید است که در اثر واکنش هیدروکسید باریم با پروکسید هیدروژن بدست می آید.
فرآیند پراکسید ها :
همانطور که قبلاً بحث شد فلزات قلیایی، پروکسید تشکیل می دهند. تعدادی دیگر از فلزات الکتریکی مثبت مانند لانتانوئیدها نیز پروکسید تشکیل می دهند. این ها از نظر خصوصیات میانه ای بین پروکسید یونی و اساسی کووالانسی هستند که توسط فلزاتی مانند روی (روی)، کادمیوم (سی دی) و جیوه (جیوه) تشکیل شده اند. یون پروکسید، O22−، دارای یک پیوند کووالانسی تک اکسیژن و حالت اکسیداسیون 1 روی اتم های اکسیژن است.
یون پروکسید یک پذیرنده یون هیدروژن قدرتمند است و باعث می شود پروکسید فلزات قلیایی و فلزات قلیایی به عنوان پایه های محکمی تبدیل شوند. محلول های این پراکسیدها به دلیل واکنش یون پروکسید با آب، اساسی هستند که در این حالت به عنوان یک اسید ضعیف عمل می کند.
O22− + H2O → O2H− + OH−
O2H− + H2O ⇌ H2O2 + OH−
پروکسید ها نیز عوامل اکسیدکننده قوی هستند. پروکسید سدیم (Na2O2) به عنوان ماده سفید کننده استفاده می شود. با اکسید کردن ترکیبات رنگی به ترکیبات بی رنگ سفید می شود.
آب اکسیژنه :
مهم ترین پروکسید کووالانسی پروکسید هیدروژن، H2O2 است. هنگام خالص بودن، این مایع چسبناک شربت دار رنگ آبی کم رنگ دارد، اگرچه تقریباً بی رنگ به نظر می رسد.
بسیاری از خصوصیات فیزیکی آن شبیه آب است. دامنه مایع آن بیشتر از آب است، در دمایC 0.43، 31.2 درجه فارنهایت ذوب می شود و در 150.2 درجه سانتیگراد (4/302 درجه فارنهایت) می جوشد و چگالی بیشتری دارد (44/1 گرم در سانتی متر مکعب در 25 درجه سانتیگراد [77 ° F]) نسبت به آب.
ثابت دی الكتریك H2O2 خالص مانند آب بسیار زیاد است. 7/70 در دمای 25 درجه سانتیگراد، در مقایسه با مقدار 4/78 برای آب در 25 درجه سانتیگراد. با این حال ، افزودن آب که از هر نظر قابل اختلاط است ، باعث می شود که ثابت دی الکتریک به حداکثر مقدار 121 در حدود 35 درصد H2O2 و 65 درصد H2O افزایش یابد. تولید جهانی H2O2 بیش از یک و نیم میلیون تن در سال است، و آن را به یک ماده شیمیایی عمده صنعتی تبدیل می کند.
آثار یون های فلزی قلیایی محلول در شیشه می تواند باعث این تجزیه شود و به همین دلیل، H2O2 خالص (یا یک محلول غلیظ) به طور معمول در بطری های روکش دار مومی یا پلاستیک ذخیره می شود. پروکسید هیدروژن یک ماده اکسید کننده قوی در محلولهای اسیدی یا اساسی است و همچنین به عنوان یک عامل کاهنده نسبت به عوامل اکسید کننده بسیار قوی مانند یون پرمنگنات، MnO4− عمل خواهد کرد. بیشترین کاربرد صنعتی پروکسید هیدروژن به عنوان سفید کننده برای موادی مانند منسوجات، کاغذ و چرم است.

این ماده در محلول رقیق به عنوان ضد عفونی کننده و ضد عفونی کننده ملایم مورد استفاده قرار می گیرد و در تولید تثبیت کننده های آلی، آغازگرهای پلیمریزاسیون، مواد درمان کننده و دارویی استفاده می شود.
سوپراکسیدها :
در یون سوپراکسید، O2−، اکسیژن دارای تعداد اکسیداسیون /1/2 است. پایداری سوپر اکسیدهای فلز به اندازه و ویژگی الکتریکی سازه فلز بستگی دارد. هرچه این فلز بزرگ تر و از نظر الکتریکی بودن بیشتر باشد، ثبات Superoxide آن بیشتر است. بنابراین ، پتاسیم (K) ، روبیدیوم (Rb) ، سزیم (Cs) ، استرانسیم (Sr) و باریم (Ba) هنگام سوزاندن در اکسیژن ، ابر اکسیدهای پایدار تشکیل می دهند. این ترکیبات جامدات فرا مغناطیسی زرد تا نارنجی هستند. آنها عوامل اکسید کننده قوی هستند که به شدت هیدرولیز می شوند (با آب واکنش می دهند) و گازهای اکسیژن و یون های هیدروکسید تولید می کنند.
2O2− + H2O → O2 + HO2− + OH−
2HO2− → 2OH− + O2
تفاوت درجه پراکسید هیدروژن با درجه غذایی و درجه فنی چیست؟
محلول های پروکسید هیدروژن پایدار نیستند و به آب و اکسیژن تجزیه می شوند. بنابراین، تفاوت در این است که درجه غذایی حاوی هیچ تثبیت کننده نیست، پروکسید هیدروژن “معمولی” احتمالاً حاوی یک تثبیت کننده است.
تاریخچه پراکسید :
پروکسید هیدروژن برای اولین بار در سال 1818 توسط لوئیس ژاک تنارد با واکنش پروکسید باریم با اسید نیتریک جدا شد. در نسخه بهبود یافته این فرآیند از اسید کلریدریک و به دنبال آن اسید سولفوریک برای رسوب محصول جانبی کلرید باریم استفاده شده است.
سوپر اکسید و پراکسید، تولید شده توسط پتروشیمی دانشمند و هلدینگ پتروشیمی خاتم (KPC)، یکی از ترکیبات حیاتی در واکنشهای شیمیایی است که با ترکیب علمی دقیق و عملکرد سریع، کیفیت فرآیندهای آزمایشگاهی و صنعتی را ارتقا میدهد و ریسکهای شیمیایی را کاهش میدهد.
| قــیـمت | نـام مـحـصول | ردیف |
| با ما تماس بگیرید. | پراکسید هیدروژن | 1 |
| با ما تماس بگیرید. | پراکسید باریم | 2 |
| با ما تماس بگیرید. | پراکسید سدیم | 3 |
| با ما تماس بگیرید. | پراکسید روی | 4 |