اسید سولفوریک | جوهر گوگرد | قیمت خرید با خلوص 98%
تاریخچه اسید سولفوریک:
در دوران باستان، با مطالعه زاج، اسید ها شناخته شدند. سومریان لیستی از انواع زاج ها داشتند که آن ها را بر اساس رنگ مواد طبقه بندی می کردند. کیمیاگران دوران قرون وسطی اسلامی نیز زاج ها را در لیست طبقه بندی مواد معدنی خود گنجانده بودند. زکریای رازی اولین فردی بود که توانست اسید سولفوریک را با استفاده از کانی های سولفات آهن و مس(II) سولفات، تولید کند. اسید سولفوریک توسط کیمیاگران اروپایی قرون وسطی “روغن ویتریول” نامیده می شد، زیرا این ماده با تفت دادن زاج سبز، (سولفات آهن (II)) در یک واکنش متقابل آهن تهیه می شد.
در قرن هفدهم، شیمی دان آلمانی-هلندی، اسید سولفوریک را با سوزاندن گوگرد همراه با نمک نیترات پتاسیم تهیه کرد. در سال 1736، جوشوا وارد، داروساز لندنی، با استفاده از این روش اولین تولید کننده بزرگ اسید سولفوریک شناخته شد.
در سال 1831، یک بازرگان بریتانیایی، با استفاده از ثبت فرآیند تماس، تولید تری اکسید گوگرد و اسید سولفوریک غلیظ را ممکن کرد. امروزه تقریباً تمام اسید سولفوریک جهان با استفاده از این روش تولید می شود.

انواع اسید سولفوریک:
یکی از پرکاربردترین مواد شیمیایی مصرفی در صنایع مختلف، اسید سولفوریک می باشد. اسید سولفوریک یک اسید بسیار قوی معدنی است که به صورت طبیعی در گازهای خارج شده از آتشفشان وجود دارد و آن را با نام های دیگری نظیر: جوهر گوگرد، اسید باتری، سولفات هیدروژن، اسید سولفین، روغن ویتریول یا روغن زاج و سولفوریک اسید می شناسند که دارای فرمول مولکولی (H2SO4)می باشد.
اسید سولفوریک یکی از انواع اسید هاست و ماده ای به شدت خطرناک است که تمایل زیادی به ترکیب با آب دارد، اما واکنش سولفوریک اسید با آب به شدت گرماده می باشد.
پودر اسید سولفوریک یا ماده موثره آن در بازار عرضه نمی گردد و این ماده بیشتر به صورت مایع به فروش می رسد. این ماده با توجه به درصد خلوص خود، از نظر ظاهری در طبیت به فرم های مختلفی می باشد، که از بی رنگ تا قهوه ای تیره، روغنی، متراکم، بدون بو و خورنده است.
اما به صورت کلی اسید سولفوریک به فرم مایع بی رنگ در نظر گرفته می شود. این ماده با هر نسبتی در آب قابل حل است و محلول در آب می باشد، بنابراین محلول های اسیدی مختلفی تولید می کند. اسید سولفوریک ویسکوز دارای گرانروی بالایی است و بسیار قطبی می باشد.
یک قطر دی الکتریک در حدود 100 دارد و این ماده از هدایت الکتریکی بسیار بالایی برخوردار است، به گونه ای که در اثر تفکیک از طریق پروتون سازی طی فرآیند اتوپروتولیز ایجاد می شود. اسید سولفوریک رایج ترین ماده شیمیایی برای کاهش pH در تصفیه آب و فاضلاب و پساب است.
جدول مشخصات فنی اسید سولفوریک:
|
نام محصول |
سولفوریک اسید |
|
فرمول شیمیایی اسید سولفوریک |
H₂SO₄ |
|
جرم مولکولی |
98.079 g/mol |
|
دانسیته |
1.83 g/cm³ |
|
نقطه جوش |
C°337 |
|
نقطه ذوب |
C° 10 |
|
pH |
2.75 |
|
شکل ظاهری |
مایع شفاف بی رنگ و بدون بو |
|
انحلال پذیری |
کاملا محلول در آب |
|
گرانروی در دمای °C 20 |
cP26.7 |
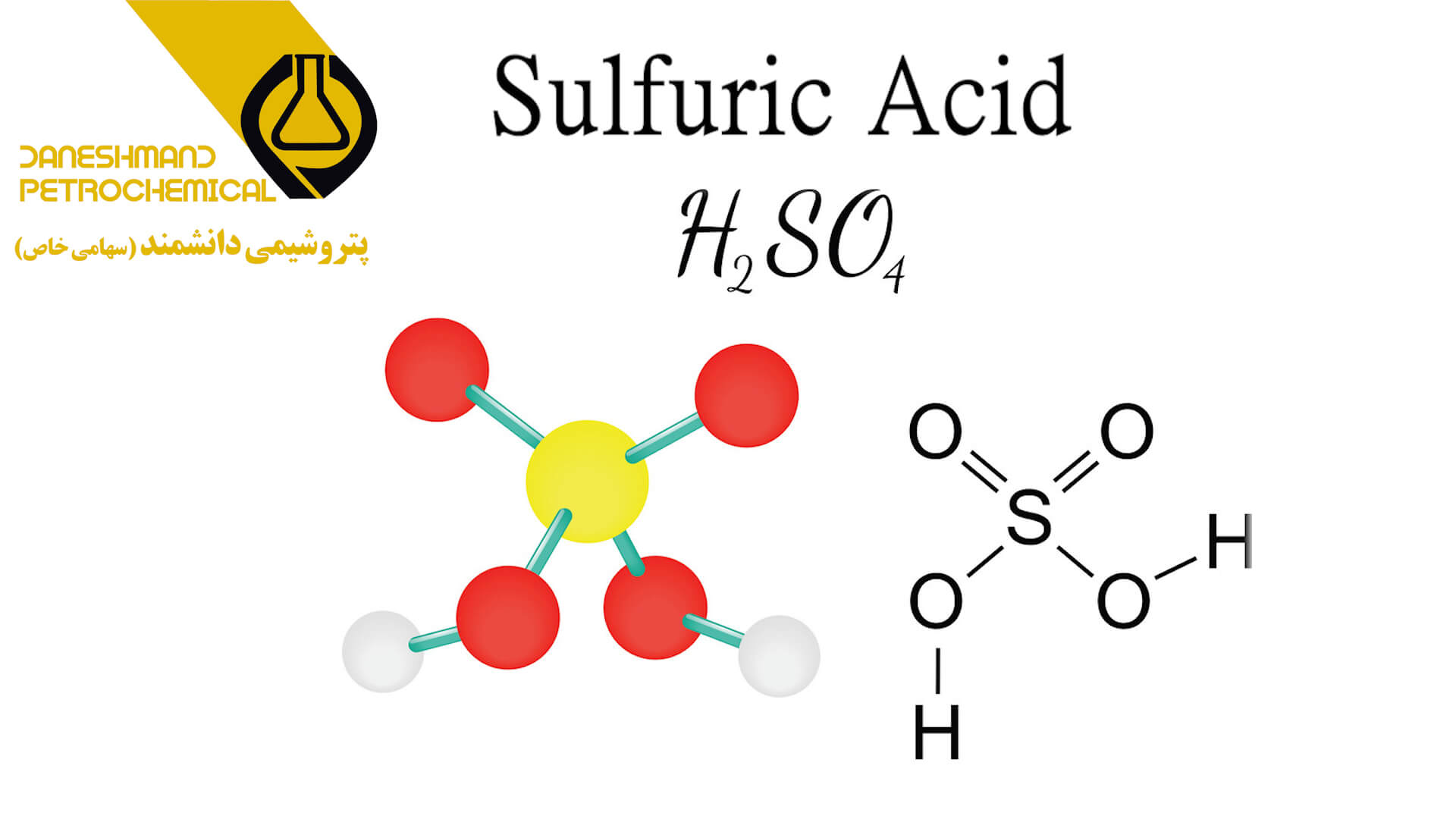
ساختار اسید سولفوریک:
سولفوریک اسید از یک اتم گوگرد، چهار اتم اکسیژن و دو اتم هیدروژن تشکیل شده است. اتم گوگرد از طریق پیوندهای دوگانه و دو گروه هیدروکسیل (OH) از طریق پیوندهای ساده یگانه به دو اتم اکسیژن متصل می شوند. این ماده اسید دیپروتیک است، زیرا می تواند دو پروتون آزاد کند.
نحوه صحیح رقیق سازی اسید سولفوریک:
به منظور رقيق سازی اسيد سولفوريك هرگز نباید به آن آب اضافه شود، زیرا سریعا با آب واکنش می دهد و باعث پاشش و جوشش اسيد می شود. نحوه ی صحیح رقیق سازی اسیدها به گونه ای است که اسيد کم کم به آب اضافه شود. یعنی در ظرف ابتدا آب باشد و سپس اسید.
اسید سولفوریک 98:
اسید سولفوریک 98% کاملا خورنده است و بخشی از باران اسیدی را تشکیل می دهد. قطره های آب به هنگام بارش با آلاینده های هوا، واکنش می دهند و اسید تولید می کنند. در واقع هر چقدر دما بالاتر رود، میزان واکنش بین قطرات و آلاینده های هوا بیشتر می شود. سولفوریک اسید در لیست مواد خطرناک قرار دارد. به اسید سولفوریک 98 درصد، اسید سولفوریک خالص نیز گفته می شود.
تولید اسید سولفوریک:
تولید اولیه اسید سولفوریک با استفاده از واکنش آب با سولفورتری اکسید، توسط جابرابن حیان در سالیان گذشته رخ داده است. این ماده با روش های مختلفی از جمله فرآیند مجاورت یا تماس، فرآیند اسید سولفوریک مرطوب، فرآیند محفظه سرب و برخی روش های دیگر نیز تولید می شود.
در واقع مهم ترین منبع تولید اسید سولفوریک، استفاده از گوگرد و بازیافت آن از گاز طبیعی و روغن است، که آن ها نیز حاوی ترکیبات گوگرد هستند. منبع مهم دیگر برای تولید اسید سولفوریک، دی اکسید گوگرد حاصل از پالایش فلز است. در واقع بسیاری از سنگ های فلزی به عنوان سولفیدها به وجود می آیند و برای تشکیل اکسید و دی اکسید گوگرد به کار می روند.

گیاهانی که به طور سنتی دی اکسید گوگرد را به جو منتقل می کنند، آن را به عنوان اسید سولفوریک بازیابی می کنند. در برخی کشورها مانند چین، بیشتر اسید سولفوریک آن ها را از سنگ چخماق، سنگ آهن و سولفید آهن ساخته می شود. اسید سولفوریک به طور طبیعی در اثر اکسیداسیون مواد معدنی سولفید در سنگ ها ایجاد می شود. اسید سولفوریک رقیق نیز در اثر رطوبت با اکسیداسیون دی اکسید گوگرد (از سوختن سوخت ها) در جو ایجاد می شود و در نهایت به صورت “باران اسیدی” رسوب می کند.
تولید سولفوریک اسید با استفاده از گوگرد:
هنگامیکه گوگرد در مجاورت اکسیژن، اکسید می شود، گوگرد دیاکسید به دست میآید. گوگرد مذاب در کوره ریخته می شود و در انفجار هوای خشک سوزانده می شود. سپس گوگرد دیاکسید در مجاورت کاتالیزگر و در واکنش با اکسیژن اضافی به گوگرد تری اکسید، تبدیل می شود. از واکنش گوگرد تریاکسید با آب، محلول سولفوریک اسید به دست می آید.
همچنین از واکنش گاز گوگرد دیاکسید باهیدروژن پراکسید یا آب اکسیژنه نیز اسید سولفوریک تولید می شود.
خواص اسید سولفوریک:
از جمله خواص سولفوریک اسید می توان به خاصیت اکسید کنندگی بالای آن اشاره کرد. این اسید جزو اسیدهای قوی محسوب می شود. مولکول های این ماده دارای گشتاور قطبی هستند، که میتوانند با یکدیگر پیوند هیدروژنی برقرار کنند.
پس سولفوریک اسید مایعی است دارای نقطه جوش بالا و همچنین ویسکوز است یعنی گرانروی زیادی دارد. این شرایط مولکولی علت به خوبی در آب حل شدن اسید سولفوریک می باشد که باعث تولید محلولهای اسیدی مختلف می شود. نمناک است و به راحتی رطوبت هوا را جذب می کند.
این یک ماده اکسید کننده قوی است و در دمای بالا با بسیاری از فلزات واکنش نشان می دهد. H₂SO₄ غلیظ نیز یک ماده خشک کننده قوی است. افزودن آب به اسید سولفوریک غلیظ یک واکنش بسیار گرمازا است و می تواند منجر به انفجار شود.
کاربرد اسید سولفوریک:
- تولید مواد دارویی
- تولید فیلم های عکاسی
- به عنوان خشک کننده قوی
- کاربرد اسید سولفوریک در شوینده و دترجنت ها
- رنگ و رزین
- در کارخانه های تولید کود شیمیایی
- تولید مواد منفجره و مهمات
- آبکاری و استخراج فلزات
- سنتز مواد شیمیایی
- کاربرد اسید سولفوریک در کشاورزی برای تولید انواع حشره کش ها
- صنایع کاغذ سازی
- پالایشگاه نفت
- باطری سازی
- فرآیندهای نیتروژن دار کردن
- کشش کاری
- تصفیه و پالایش روغن
- تصفیه فاضلاب های صنعتی
- صنعت نساجی
- فرآوری مواد معدنی
- تولید اسید هیدروفلوریک، فنل و پروپانول
- ساخت چسب
- صنایع سلولزی برای تولید دستمال کاغذی، روزنامه و مقوا
شرایط نگهداری اسید سولفوریک:
به دلیل خطرناک بودن این ماده و به منظور جلوگیری از خطرات ناشی از اسید سولفوریک برای نگهداری این محصول از ظروف چند لایه پلی اتیلنی استفاده می شود. در ضمن لازم است بدانید که این ماده باید به دور از نور خورشید نگهداری شود.
این اسید در زمره مواد خطرناک قرار داشته و بسیار قوی و خورنده است و تنفس آن بسیار خطرناک میباشد.
لیست قیمت اسید سولفوریک:
|
ردیف |
نام محصول |
قیمت |
|
1 |
قیمت سولفوریک اسید |



