اسید نیتریک
اسید نیتریک به عنوان آب قوی و روح نیتر شناخته می شود، که یک اسید معدنی بسیار خورنده است. این ماده به صورت ترکیب خالص بی رنگ است، اما در نمونه های قدیمی تر به دلیل تجزیه شدن در اکسیدهای نیتروژن و آب، گچ زرد پیدا می کردند. به منظور دریافت اطلاعات تکمیل تر و جهت خرید این محصول با بخش فروش پتروشیمی دانشمند تماس بگیرید.
اسید نیتریک چیست؟
این ماده اسيدی قوی با خاصيت اكسيدكنندگی است و معرف اصلی نیترات (همانند افزودن یک گروه نیترو به یک مولکول آلی) می باشد. نیتریک اسید محلول در آب است و همچنین نوعی اکسید کننده قوی است که بسیار خورنده و سمی می باشد. این ماده با فلزات، اکسیدها و هیدروکسیدها واکنش داده و نمک های نیترات را تشکیل می دهد.
اسید نیتریک غلیظ یا خالص، در دمای اتاق به صورت مایعی بی رنگ است. نیتریک اسید، یک آزوتروپ با آب در غلظت 68٪ HNO3 است. این محلول دارای دمای جوش 120.5 درجه سانتیگراد در فشار 1 اتمسفر می باشد. اسید نیتریک در معرض تجزیه حرارتی است و به این علت اغلب در بطری های شیشه ای قهوه ای تیره نگهداری می شود:
HNO3 → 2 H2O + 4 NO2 + 4 O2
طی این واکنش امکان ایجاد برخی تغییرات غیر قابل اغماض در فشار بخار بالای مایع، وجود دارد. زیرا اکسیدهای نیتروژن حاصله به طور جزئی یا کامل در اسید حل می شوند. دی اکسید نیتروژن (NO2) در اسید نیتریک محلول باقی مانده و در دماهای بالاتر آن را زرد یا حتی قرمز رنگ می کند. در حالی که اسید نیتریک خالص تمایل دارد تا در معرض هوا، بخارهای سفید رنگ ایجاد کند. نیتریک اسید با دی اکسید نیتروژن محلول، بخارهای قهوه ای مایل به قرمز رنگ تشکیل می دهد. در نتیجه “اسید نیتریک بخور دهنده قرمز” و “اسید نیتریک بخور دهنده سفید” نامیده می شوند. اکسیدهای نیتروژن (NOx) در اسید نیتریک محلول هستند.
برخی از ترکیبات حاصل از نیتروژن مواد منفجره حساس به شوک و حرارت هستند، تعدادی از آن ها به اندازه کافی پایدار هستند که می توانند در مهمات و تخریب استفاده شوند، در حالی که برخی دیگر هنوز پایدارتر هستند و به عنوان رنگدانه در جوهرها و رنگ ها استفاده می شوند.
آب باران حاوی کمی اسید نیتریک می باشد.
تجزیه اسید نیتریک:
نیتریک اسید در دمای معمولی به مقدار کمی تجزیه می شود، اما در اثر گرم شدن یا قرار گرفتن در معرض نور مستقیم خورشید، به شدت و با سرعت بیشتری تجزیه می شود. بنابراین تاکید شده است که این ماده را در ظروف تیره رنگ قرار دهید. در اثر تجزیه رنگ آن به زرد یا قهوه ای تغییر می یابد. اسید نیتریک با اکثر فلزات، به استثنای طلا و پلاتین، برای تولید نیترات واکنش می دهد.
اسید نیتریک خالص بی رنگ می باشد اما نمونه های قدیمی تر به دلیل تجزیه به اکسیدهای ازت و آب، به رنگ زرد تبدیل می شدند.
اسامی دیگر اسید نیتریک:
نیتریک اسید را با نام های نظیر ازوتیک اسید یا اسید ازوتیک، نیترات هیدروژن یا هیدروژن نیترات، جوهر شور، اسید ازته و نیتروکسید آنیل نیز شناخته می شود.
غلظت های محلول اسید نیتریک:
غلظت بیشتر اسید نیتریک هایی که به بازار عرضه می شوند 68٪ است. هنگامی که محلول بیش از 86٪ اسید نیتریک داشته باشد، به عنوان اسید نیتریک بخور مصرف می شود. با توجه به مقدار دی اکسید نیتروژن موجود، بخور اسید نیتریک بیشتر به عنوان بخار اسید نیتریک قرمز در غلظت های بالاتر از 86٪ یا اسید نیتریک بخور سفید در غلظت های بالاتر از 95٪ نشان داده می شود.
جدول مشخصات فنی اسید نیتریک:
نام ماده | نیتریک اسید |
فرمول شیمیایی اسید نیتریک | HNO₃ |
جرم مولکولی | 63.01 g/mol |
دانسیته | 1.51 g/cm³ |
نقطه جوش | 83 °C |
نقطه ذوب | -42 °C |
pH | 1 |
شکل ظاهری | مایع بی رنگ مایل به زرد خیلی روشن |
تاریخچه اسید نیتریک:
در قرن شانزدهم به منظور جداسازی طلا از نقره، اسید نیتریک مصرف می شد. این ماده توسط حرارت دادن نمک و سولفات آهن به دست می آمد.
تولید صنعتی اسید نیتریک از هوای جوی در سال 1905 توسط فرآیند قوس آغاز شد. این فرآیند بر طبق اکسیداسیون نیتروژن جوی از طریق اکسیژن اتمسفر به اکسید نیتریک با قوس الکتریکی در دمای بسیار بالا اتفاق می افتد.
روش تولید اولیه دیگر توسط مهندس فرانسوی آلبرت نودون در حدود سال 1913 اختراع شد. روش وی اسید نیتریک از الکترولیز نیترات کلسیم را که توسط باکتری ها از مواد نیتروژن دار در ذغال سنگ نارس تبدیل شده است، تولید کرد.
تولید اسید نیتریک:
اسید نیتریک از واکنش دی اکسید نیتروژن (NO2) و آب تولید می شود. اکسید نیتریک تولید شده با اکسیژن هوا اکسید شده و دی اکسید نیتروژن تولید می کند.
اسید نیتریک مایع تجاری که به بازار عرضه می شود معمولاً حاوی 52٪ تا 68٪ اسید نیتریک خالص است. تولید اسید نیتریک از طریق فرآیند استوالد صورت می گیرد که برگرفته از نام ویلهلم استوالد شیمی دان آلمانی می باشد. در این فرآیند، آمونیاک بی آب در حضور کاتالیزور گاز پلاتین یا رودیم در دمای بالا حدود 500 K و فشار 9 atm به اکسید نیتریک، تبدیل می شود. سپس نیتریک اکسید با اکسیژن هوا واکنش داده و دی اکسید نیتروژن تولید می شود. این امر متعاقباً در آب جذب می شود، تا اسید نیتریک و اکسید نیتریک تشکیل شود.
اسید نیتریک معرف اصلی برای نیتراسیون است. از افزودن یک گروه نیترو به یک مولکول آلی، اسید نیتریک تولید می شود.
اسید نیتریک آبی به دست آمده می تواند با تقطیر تا حدود 68٪ از نظر جرم غلیظ شود. غلظت بیشتر تا 98٪ را می توان با کمبود آب با H2SO4 غلیظ به دست آورد. با استفاده از آمونیاک مشتق شده از فرآیند هابر، می توان محصول نهایی را از نیتروژن، هیدروژن و اکسیژن تولید کرد که از هوا و گاز طبیعی به عنوان منبع اصلی تولید می شود.
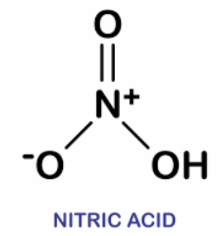
ساختار اسید نیتریک:
نیتریک اسید دارای یک اتم هیدروژ, (H) یک اتم نیتروژن (N) و سه اتم اکسیژن (O) است. ساختار آن مسطح است. اسید نیتریک ذوب شده، اسید نیتریک غلیظی است که حاوی دی اکسید نیتروژن محلول می باشد. اسید نیتریک بوی شدیدی دارد و در آب کاملا محلول است. از آن برای تنظیم محیط اسیدی و همچنین به عنوان اکسنده نیز استفاده می شود. آمونیاک، ماده اولیه تولید این اسید صنعتی می باشد.
اسید نیتریک خشک یا بی آب:
دفع اسید نیتریک سفید، اسید نیتریک خالص یا WFNA، بسیار نزدیک به اسید نیتریک بی آب است. با سنجش به عنوان اسید نیتریک 9/99 درصد در دسترس است. از مشخصات اسید نیتریک بخور سفید است که حداکثر 2٪ آب و حداکثر 0.5٪ NO2 محلول دارد. اسید نیتریک بی آب دارای تراکم 1.513 گرم در سانتی متر مکعب است و غلظت تقریبی آن 24 مولار است. اسید نیتریک خشک یک مایع متحرک بی رنگ با تراکم 1.512 گرم بر سانتی متر مکعب است که در دمای 42- درجه سانتیگراد توانایی جامد شدن دارد و بلورهای سفید رنگ تشکیل می دهد که نیاز به شفاف سازی دارد. با تجزیه شدن آن به NO2 و آب، رنگ زرد به دست می آورد. در دمای 83 درجه سانتی گراد می جوشد. این ماده معمولاً در یک بطری شیشه ای کهربای نشکن و با حجمی دو برابر نگهداری می شود، تا امکان ایجاد فشار فراهم شود. اما با این اقدامات احتیاطی بطری باید ماهیانه تخلیه شوند تا فشار خارج شود.
کاربرد اسید نیتریک:
از اسید نیتریک معمولاً به عنوان یک ماده اکسید کننده قوی استفاده می شود. اصلی ترین کاربرد صنعتی اسید نیتریک برای تولید کودها است. اسید نیتریک با آمونیاک خنثی می شود و نیترات آمونیوم می دهد. سایر کاربردهای اصلی تولید مواد منفجره، پیش سازهای نایلون و ترکیبات آلی ویژه است. نیتریک اسید به عنوان اکسید کننده در ساخت پیش ماده نایلون به کار می رود.
در صنایع غذایی به منظور جلوگیری از رشد باکتری ها و مسمومیت های غذایی کشنده از اسید نیتریک استفاده می شود. این ماده به عنوان افزودنی به گوشت تازه و برای ثابت ماندن رنگ گوشت به کار می رود.همچنین در تانکرهای حمل شیراز گاوداری به کارخانه های لبنیات پس از تخلیه، تانکر مورد نظر را با اسید نیتریک شستشو می دهند. به عنوان نگهدارنده در پردازش گوشت مانند: سوسیس، کالباس، انواع بیف ها، بیکن ها، همبرگر از اسید نیتریک استفاده می کنند.
لیست قیمت اسید نیتریک:
ردیف | نام محصول | قیمت |
1 | قیمت نیتریک اسید | تماس بگیرید |