کربنات کلسیم
کربنات کلسیم یکی از پرمصرف ترین مواد خام در جهان است و کاربردهای جدید آن دائماً در حال توسعه است، بنابراین احتمالاً استفاده از آن تا هزاره های بعدی نیز رشد خوبی خواهد داشت.
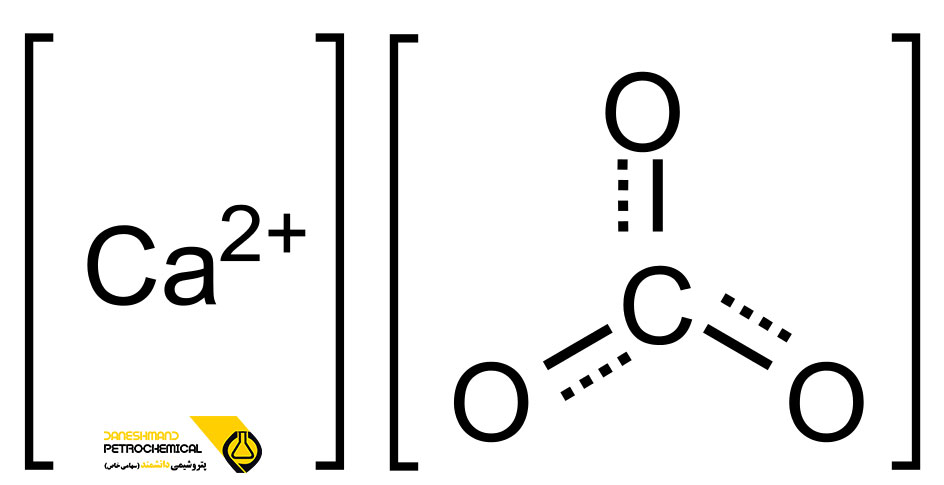
کربنات کلسیم یک ماده معدنی با فرمول شیمیایی CaCO3 می باشد. کربنات کلسیم را با نام هایی نظیر گچ فرنگی، سنگ آهک، کلسیت، آراگونیت و سنگ مرمر نیز می شناسند. این ماده از نظر شکل ظاهری به صورت یک پودر کرکی سفید رنگ است. این ماده متداول در سنگ ها به عنوان مواد معدنی کلسیت و آراگونیت (به ویژه سنگ آهک که نوعی سنگ رسوبی است و عمدتا از کلسیت تشکیل شده است) است و جز اصلی مرواریدها و پوسته های موجودات دریایی، حلزون ها و تخم ها می باشد. کلسیت پایدارترین پلی مورف کربنات کلسیم به صورت شفاف و مات است.
برای ایجاد نور قطبی در قرن نوزدهم از یک نوع شفاف به نام اسپار ایسلند استفاده شد. از نظر منابع زمین شناسی کلسیت، آراگونیت و واتریت از مواد معدنی خالص کربنات کلسیم هستند. سنگ های مهم صنعتی که عمدتا کربنات کلسیم هستند شامل سنگ آهک، گچ، سنگ مرمر و سنگ تراورتن هستند. فراتر از زمین، شواهد قوی حاکی از وجود کربنات کلسیم در مریخ است.
شکل غیرمعمول کربنات کلسیم هگزاهیدرات، ایکائیت، CaCO3·6H2O است. ایکایت فقط در دمای 8 درجه سانتیگراد پایدار می باشد.
کربنات کلسیم ماده موثره آهک کشاورزی می باشد و هنگامی ایجاد می شود که یون های کلسیم در آب سخت با یون های کربنات واکنش داده و آهک ایجاد می کنند. این دارو به عنوان مکمل کلسیم یا ضد اسید نیز استفاده می شود، اما مصرف زیاد آن می تواند خطرناک باشد و باعث هضم نامناسب شود. از نظر خواص، کربنات کلسیم مشابه سایر کربنات ها است.
تاریخچه کربنات کلسیم
کربنات کلسیم 40،000 سال قبل از میلاد تا به امروز مورد استفاده قرار گرفته است. انگلوساکسون ها از گچ به عنوان پودر سفید کننده یاد می کردند. شرط اصلی گسترش گچ بر سایر اشکال کربنات کلسیم، سهولت استخراج و فرآوری آن بود. آنگلوساکسون ها در اطراف ساحل جنوبی، گچ استخراج کردند. آن ها دریافتند که سنگ نرم می تواند به راحتی با ابزارهای ساده مانند اره و تبر استخراج شود. به علاوه معمولاً فقط خرد كردن تكه های گچ برای توليد پودر با كيفيت لازم كافی بود.
دهه 1700 بتونه لعاب دهنده اولین درزگیر که با استفاده از کربنات کلسیم ساخته شده است.
دهه 1800 انقلاب صنعتی تقاضا برای شستشوی سنگ اهلی را پیش می برد. افزایش زیاد در ساخت و ساز ساختمان های آجری و سنگی در قرن 18 و 19 باعث افزایش استفاده از کربنات کلسیم در سنگ آهک و رنگ شد. انقلاب صنعتی همچنین تقاضای پودرهای کربنات کلسیم را از خانه های رنگی و چاپگرها ایجاد کرد. تأمین کنندگان کربنات کلسیم نیز روش های تولید صنعتی را آغاز کردند.
اواخر قرن بیستم قرن تولید انبوه شیشه با استفاده از سنگ آهک رواج یافت.

منابع طبیعی کربنات کلسیم
در آب های گرمسیری گرم و شفاف مرجان ها بیشتر از قطب هایی هستند که آب ها سرد است. کربنات کلسیم، از جمله پلانکتون ها (مانند کوکولیت ها و روزن داران پلانتیک)، جلبک های مرجان، اسفنج ها، براکیوپدها، اکینودرم ها، بریوزوها و نرم تنان، به طور معمول در محیط های کم عمق آب، که نور خورشید و مواد غذایی قابل تصفیه در آن ها زیاد است، یافت می شوند. کربنات های آب سرد در عرض های جغرافیایی بالاتر وجود دارند، اما سرعت رشد آن ها بسیار کند است. فرآیندهای کلسیفیکاسیون توسط اسیدی شدن اقیانوس تغییر می کند. در جایی که پوسته اقیانوسی در زیر یک صفحه قاره فرورفته می شود، به مناطق گرم تر در آدنوسفر و لیتوسفر منتقل می شود. در این شرایط کربنات کلسیم تجزیه می شود و دی اکسید کربن تولید می کند که همراه با گازهای دیگر باعث فوران های آتشفشانی منفجره می شود.
عمق جبران کربنات (CCD) نقطه ای در اقیانوس است که سرعت بارش کربنات کلسیم در آن به دلیل شرایط موجود با سرعت انحلال، متعادل می شود. اعماق اقیانوس، دما کاهش می یابد و فشار افزایش می یابد. کربنات کلسیم به این دلیل غیرمعمول است که با کاهش دما، میزان حلالیت آن افزایش می یابد. افزایش فشار همچنین باعث افزایش حلالیت کربنات کلسیم می شود. عمق جبران کربنات می تواند از 4000 تا 6000 متر زیر سطح دریا باشد.
کربنات کلسیم می تواند فسیل ها را از طریق تولید مواد معدنی حفظ کند.

جدول مشخصات فنی کربنات کلسیم
| نام آیوپاک کربنات کلسیم | Calcium carbonate |
| فرمول شیمیایی کربنات کلسیم | CaCO3 |
| جرم مولکولی | 100.0869 g/mol |
| دانسیته | 2.71 g/cm³ |
| نقطه ذوب | 825 °C |
| انحلال پذیری در آب | نامحلول |
| شکل ظاهری | پودر سفید رنگ |
| نقطه جوش | تجزیه می شود. |
تولید کربنات کلسیم:
اکثریت قریب به اتفاق کربنات کلسیم مورد استفاده در صنعت با استخراج معادن استخراج می شود. کربنات کلسیم خالص (مانند مواد غذایی یا دارویی)، می تواند از یک منبع استخراج خالص (معمولاً سنگ مرمر) تولید شود. متناوباً، کربنات کلسیم از اکسید کلسیم تهیه می شود. آب اضافه می شود تا هیدروکسید کلسیم داده شود، سپس دی اکسید کربن از این محلول عبور می کند تا کربنات کلسیم مورد نظر را رسوب دهد، که در صنعت به آن کربنات کلسیم رسوب داده شده (PCC) می گویند:
CaO + H2O → Ca(OH)2
Ca(OH) 2 + CO2 → CaCO3 ↓ + H2O

به طور کلی چند روش برای تولید کربنات کلسیم وجود دارد که در ادامه به آن ها می پردازیم:
- CaCO3 با استفاده از دی اکسید کربن و آهک ذوب شده به عنوان مواد اولیه به دست می آید. وقتی دی اکسید کربن از آهک ذوب شده عبور می کند، کلسیت به دست می آید.
- روش دیگر برای به دست آوردن کلسیت، افزودن کربنات سدیم به کلرید کلسیم است.
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
هنگامی که دی اکسید کربن بیش از حد عبور می کند منجر به تشکیل کلسیم هیدروژن کربنات می شود.
- در مقیاس بزرگ، با عبور گاز دی اکسید کربن از طریق هیدروکسید کلسیم (آهک ذوب شده) کربنات کلسیم تهیه می شود. با این حال، اگر دی اکسید کربن بیش از حد عبور کند، کلسیم محلول هیدروژن کربنات را تشکیل می دهد.
Ca(OH)2 + CO2 → CaCO3 + H2O
انواع کربنات کلسیم:
از نظر حجم بازار، GCC مهمترین نوع پرکننده ای است که در حال حاضر استفاده می شود. سه نوع سنگ حاوی کربنات کلسیم در صنعت حفاری شده و مورد استفاده قرار می گیرد. آن ها سنگ آهک، گچ و دولومیت هستند. سنگ آهک و گچ هر دو شکل کربنات کلسیم هستند و دولومیت مخلوطی از کربنات های کلسیم و منیزیم است.
- کربنات کلسیم خوراکی
- کربنات کلسیم صنعتی (PCC , GCC)
کربنات کلسیم خوراکی
کربنات کلسیم یک مکمل غذایی است که وقتی مقدار کلسیم در رژیم غذایی کافی نباشد، استفاده می شود. کلسیم برای سلامت استخوان ها، عضلات، سیستم عصبی و قلب مورد نیاز بدن است. همچنین از کربنات کلسیم به عنوان ضد اسید برای رفع سوزش معده، سوءهاضمه اسید و ناراحتی معده استفاده می شود. این دارو با نسخه یا بدون نسخه در دسترس است.

کربنات کلسیم صنعتی:
کربنات کلسیم به صورت تجاری در دو درجه مختلف تولید می شود. هر دو درجه به طور عمده بر اساس اندازه ذرات و خصوصیات منتسب به یک محصول رقابت می کنند.
کربنات کلسیم زمین: تولید شده از طریق استخراج و پردازش رسوبات طبیعی است. شکل کریستال GCC به طور نامنظم لوزی است و توزیع اندازه وسیع تری دارد.
کربنات کلسیم رسوبی: از طریق بارش شیمیایی از طریق فرآیند کربوکاسیون یا به عنوان محصول جانبی برخی از فرآیندهای شیمیایی فله تولید می شود. شکل کریستال PCC به محصول بستگی دارد و ذرات با توزیع اندازه باریک یکنواخت تر و منظم ترند.
PCC ذرات كوچكتری دارد كه خلوص آن بيشتر است و سايش كمتری دارد و از روشنايی بيشتری نسبت به GCC برخوردار است.
واکنش کربنات کلسیم با اسیدها:
این ماده با اسیدها واکنش نشان می دهد و دی اکسید کربن آزاد می کند (اما به سرعت به CO2 و H2O آزاد می شود).
CaCO3(s) + 2H+(aq) → Ca2+(aq) + CO2(g) + H2O(l)
دی اکسیدکربن را هنگام گرم شدن آزاد می کند، که به آن واکنش تجزیه حرارتی یا کلسیناسیون گفته می شود. کربنات کلسیم تا دمای 840 درجه سانتیگراد، تشکیل اکسید کلسیم می دهد، که معمولاً آهک سریع نامیده می شود. آنتالپی واکنش 178 کیلوژول بر مول می باشد:
CaO(s) + CO2(g)→ CaCO3(s)
کربنات کلسیم با آب اشباع شده توسط دی اکسید کربن واکنش داده و بی کربنات کلسیم محلول را تشکیل می دهد:
CaCO3(s) + CO2(g) + H2O(l) → Ca(HCO3)2(aq)
این واکنش در فرسایش سنگ کربنات، تشکیل غارها مهم است و منجر به آب سخت در بسیاری از مناطق می شود.
کاربرد کربنات کلسیم:
کربنات کلسیم در صنعت کاربردهای گسترده ای دارد:
- برای تولید محصولات مراقبت شخصی
- ساخت روغن
- تولید پلاستیک و لاستیک
- در صنعت ساختمان و سیمان به عنوان ماده اولیه
- شیشه سازی
- صنایع فولاد
- در صنعت کاغذسازی از GCC و PCC به عنوان ماده پر کننده در کاغذ استفاده می شود.
- تولید آهک باغچه یا آهک کشاورزی (مسئول آرام سازی اسیدیته مضر خاک)
- تنظیم pH خاک
- افزایش توانایی احتباس آب در خاک اسیدی
- افزایش جذب مواد مغذی در خاک
- برای راه سازی
- سوزاندن در کوره
- برای سفیدکاری
- در تصفیه آهن از سنگ آهن در کوره بلند
- به عنوان ماده اولیه در تصفیه شکر از چغندرقند
- برای تولید اکسید کلسیم و دی اکسید کربن در کوره با آنتراسیت کلسینه
- ماده اصلی گچ تخته سیاه
- کربنات کلسیم رسوبی (PCC)، که به صورت دوغاب پراکنده شده است، ماده پرکننده ای معمول برای دستکش های لاتکس می باشد.
- به عنوان یک تصحیح کننده PH برای حفظ قلیائیت و جبران خواص اسیدی ماده ضد عفونی کننده به استخرها
- در حفاری به عنوان ماده ای سازنده پل و مهر و موم کننده کیک فیلتر استفاده می شود، همچنین ماده وزنی است که تراکم مایعات حفاری را برای کنترل فشار چاه افزایش می دهد.
- کربنات کلسیم ریز آسیاب شده (GCC) یک ماده اساسی در فیلم ریز متخلخل ساختمانی است.
- کربنات کلسیم به طور گسترده ای به عنوان ماده گسترش دهنده در رنگ ها استفاده می شود، به ویژه رنگ امولسیون مات که به طور معمول 30٪ از وزن رنگ یا گچ یا سنگ مرمر است.
- ترکیبات پلی پروپیلن اغلب با کلسیم پر می شوند.
- به عنوان پرکننده در رزین های حرارتی (ورق و ترکیبات قالب گیری فله ای) استفاده می شود.
- برای قالب گیری فشرده سازی از انواع تراشه های رس با ABS و سایر مواد مخلوط می شود.
- تولید چسب های کاشی و سرامیک که معمولاً حاوی 70٪ تا 80٪ سنگ آهک هستند.
- ساخت فیلرها یا پرکننده های ترک تزئینی
- در تنظیم شیشه های ویترای با بتونه مخلوط می شود و به عنوان مقاومت در برابر جلوگیری از چسبیدن شیشه به قفسه های کوره هنگام شلیک لعاب و رنگ در دمای بالا.
- به عنوان سفید کننده در لعاب سرامیک
- به عنوان پودر تمیز کننده و هم به عنوان ماده تشکیل دهنده کرم های تمیز کننده خانگی
- در صنعت داروسازی به عنوان ماده پر کننده بی اثر برای قرص ها و سایر داروها
- کربنات کلسیم همچنین در برنامه های گوگردزدایی گاز دودکش استفاده می شود و انتشار مضر SO2 و NO2 از زغال سنگ و سایر سوخت های فسیلی سوخته در نیروگاه های بزرگ سوخت فسیلی را حذف می کند.
- کاهش اثرات مخرب باران اسیدی در کل اکوسیستم های آب رودخانه
کاربرد کربنات کلسیم در صنعت غذا و دارو:
کربنات کلسیم به طور گسترده ای از نظر دارویی به عنوان مکمل غذایی کلسیم برای آنتی اسید معده استفاده می شود. از کربنات کلسیم در تولید اکسید کلسیم و همچنین خمیر دندان استفاده می شود و به عنوان ماده نگهدارنده مواد غذایی و نگهدارنده رنگ، هنگام استفاده در محصولاتی مانند سیب های ارگانیک، دوباره احیا شده است.
کربنات کلسیم از نظر درمانی به عنوان چسب فسفات در بیماران تحت همودیالیز نگهدارنده استفاده می شود. رایج ترین نوع اتصال دهنده فسفات است که به ویژه در بیماری های مزمن کلیوی غیر دیالیز تجویز می شود. کربنات کلسیم معمولاً از چسب فسفات استفاده می شود، اما پزشکان به طور فزاینده ای گران قیمت تر، چسب های فسفات غیر کلسیم، به ویژه سولمر را تجویز می کنند.
به عنوان یک افزودنی غذایی E170 نامگذاری شده است. به عنوان تنظیم کننده اسیدیته، ماده ضد پخت، تثبیت کننده یا رنگ مورد استفاده است. این ماده در برخی شیرهای سویا و فرآورده های شیر بادام به عنوان منبع کلسیم خوراکی نیز استفاده می شود. یک مطالعه نشان می دهد کربنات کلسیم ممکن است به اندازه کلسیم موجود در شیر گاو قابل دسترس باشد. کربنات کلسیم همچنین به عنوان عامل سفت کننده در بسیاری از محصولات گیاهی کنسرو شده و بطری استفاده می شود.
موجودات زنده برای تشکیل استخوان و دندان به کربنات کلسیم نیاز دارند!
و شما یکی از آن ها هستید! آیا می دانید دندان و استخوان شما از دوز سالم کربنات کلسیم ساخته شده است؟ به همین ترتیب، گیاهان و حیوانات از این ماده معدنی برای ساخت اسکلت و پوسته های خود استفاده می کنند. حیواناتی که از این نظر بیشتر مورد توجه هستند شامل حلزون، مرجان، مروارید، لاک پشت و سایر موجودات پوسته دار هستند. کربنات کلسیم با مرگ گیاهان و حیوانات میزبان ماده، مجدداً به خاک رسوب می کند.
آیا سنگ آهک یک کربنات کلسیم است؟
این یک سنگ کربنات رسوبی است که غالباً از قسمت های اسکلتی موجودات دریایی مانند مرجان، سوراخ کن و نرم تنان تشکیل شده است.
تست وجود کربنات کلیسم در ترکیبات:
برای ارزیابی وشناسایی نمک کربنات برای اینکه بدانیم ماده معدنی یا سنگ حاوی کربنات کلسیم است، می توان اسیدهای قوی مانند اسید کلریدریک اضافه کرد. اگر نمونه حاوی کربنات کلسیم باشد، دی اکسید کربن گازدار شده و تولید می شود.
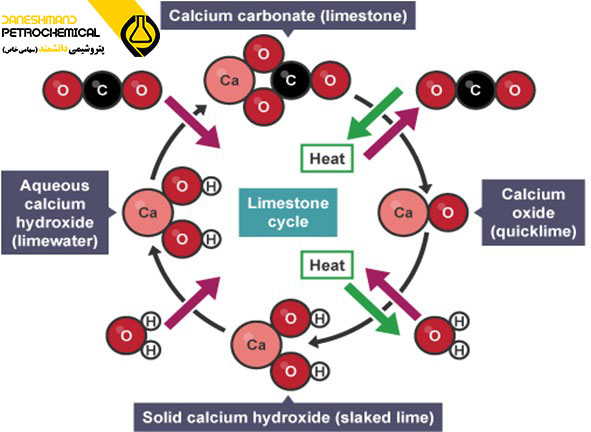
کربنات کلسیم و اکسید کلسیم:
کربنات کلسیم، اکسید کلسیم و هیدروکسید کلسیم همه از سنگ آهک ساخته شده اند و کاربردهای مهمی دارند. کربنات کلسیم به طور طبیعی در سنگ آهک یافت می شود. وقتی سنگ آهک به شدت گرم می شود، کربنات کلسیم موجود در آن گرما را جذب می کند (گرماگیر) و تجزیه می شود و اکسید کلسیم تشکیل می شود. این امر با گرم شدن سنگ آهک با درخشش نارنجی نشان داده می شود.
کربنات کلسیم ox اکسید کلسیم + دی اکسید کربن
CaO(s) + CO2(g) → CaCO3(s)
لیست قیمت کربنات کلسیم:
| ردیف | نوع محصول | قیمت |
| 1 | قیمت کلسیم کربنات | تماس بگیرید |
